
परमाणु की खोज –
सन् 1808 मे ब्रिटिश वैज्ञानिक डाल्टन ने बताया प्रत्येक पदार्थ छोटे-छोटे टुकड़ों से मिलकर बना होता है जिन्हें (atom)परमाणु का जाता हैAtom ग्रीक शब्द है जिसका अर्थ होता है अविभाज्यअगर हम किसी पदार्थ को छोटे-छोटे टुकड़ों में तोड़ दिया जाए तो एक ऐसी स्थिति आती है जब उस पदार्थ को और अधिक टुकड़ों में नहीं तोड़ा जा सकता है
अर्थात
वह कण जिसको को विभाजित नहीं किया जा सकता वह अविभाज्य होता है परमाणु कहलाता है
किसी भी तत्व के सभी परमाणु का आकार, द्रव्यमान और गुण समान होते हैं परंतु अलग-अलग तत्वों के परमाणु आकार व द्रव्यमान एवं गुण अलग-अलग होते हैं
पदार्थ – वह वस्तु जिसका द्रव्यमान होता है और इस स्थान कहती है पदार्थ कहलाता है
डाल्टन का परमाणु सिद्धांत –
डाल्टन के अनुसार परमाणु पदार्थ की सबसे छोटी इकाई होते हैं जिसको विभाजित नहीं किया जा सकता है परमाणु को ना है तो उत्पन्न किया जा सकता है और ना नष्ट किया जा सकता है किसी भी एक तत्व के सभी परमाणु का आकार ,द्रव्यमान और गुण समान होते हैं परंतु अलग-अलग तत्व के परमाणु आकार द्रव्यमान एवं गुण अलग-अलग होते हैं
डाल्टन के परमाणु सिद्धांत के लगभग 100 सालों तक यही माना गया कि परमाणु अविभाज्य कण होता है परंतु बीसवीं शताब्दी की शुरुआत में वैज्ञानिकों ने अपने अनेक प्रयोग प्रयोगों के आधार पर बताए कि परमाणु को विभाजित किया जा सकता है
परमाणु 3 मूलभूत कणों से मिलकर बना हुआ होता है
1.इलेक्ट्रॉन 2. प्रोटोन 3. न्यूट्रॉन
1. इलेक्ट्रॉन –
इलेक्ट्रॉन की खोज सन् 1897 मे जे. जे. थॉमसन ने की थी इलेक्ट्रॉन एक ऋण आवेशित कण होता है जिसका द्रव्यमान 9.109×10⁻³¹kg होता है
2. प्रोटोन –
इलेक्ट्रॉन पर आवेश मौजूद होता है फिर भी परमाणु उदासीन होता है इसी विचार के आधार पर सन 1920 में एक भौतिक वैज्ञानिक गोल्ड स्टिन ने की प्रोटोन का द्रव्यमान इलेक्ट्रॉन के द्रव्यमान के समान ही होता है
3. न्यूट्रॉन –
परमाणु के अंदर ऋण आवेशित कण इलेक्ट्रॉन धन आवेशित कण प्रोटोन होते हैं पर परमाणु का द्रव्यमान इलेक्ट्रॉन ,प्रोटॉन के कुल द्रव्यमान से कम बैठता है तो वैज्ञानिकों ने सोचा कोई अन्य उदासीन कण मौजूद है इस आधार पर सन 1932 में जेम्स चैडविक ने न्यूट्रॉन की खोज की न्यूट्रॉन का द्रव्यमान प्रोटोन के द्रव्यमान से कुछ ज्यादा होता है
अब तक परमाणु मे 35 से ज्यादा सूक्ष्म कणो को खोजा जा चुका है जिनमे कुछ आवेशित व कुछ अनावेशित कण है
परमाणु की संरचना –
परमाणु की संरचना समझाने के लिए अनेक वैज्ञानिकों ने अपने परमाणु मॉडल प्रस्तुत किये जो निम्नानुसार है
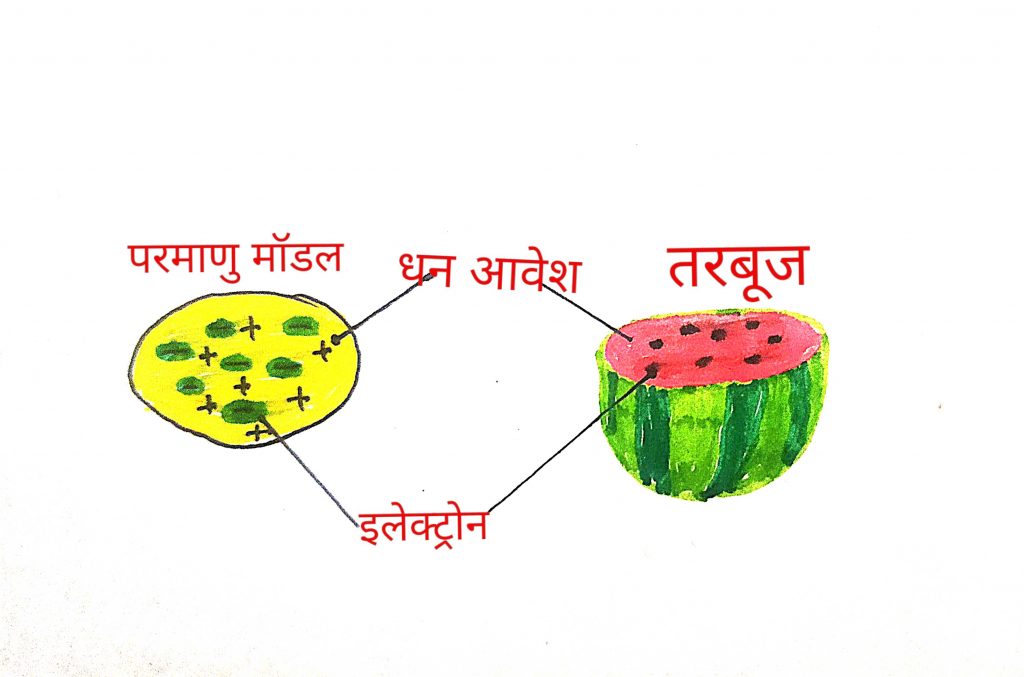
जे. जे. थॉमस का परमाणु मॉडल –
वैज्ञानिक जे. जे. थॉमस ने बताया की परमाणु एक 10⁻¹⁰m की त्रिज्या का गोला होता है जिसमे धन आवेश समान रूप फैला हुआ होता है और उसमे ऋण आवेश धास हुआ होता है इस मॉडल मे यह भी बताया गया की परमाणु का द्रव्यमान समान रूप से फैला हुआ होता है
इस मॉडल की तुलना तरबूज व पलनपुड्डी से भी की जाती है तरबूज मे धनावेश समान रूप से फैला हुआ होता है और ऋण आवेश तरबूज के बीज की तरह धसा हुआ होता है
रदरफोर्ड का परमाणु मॉडल –
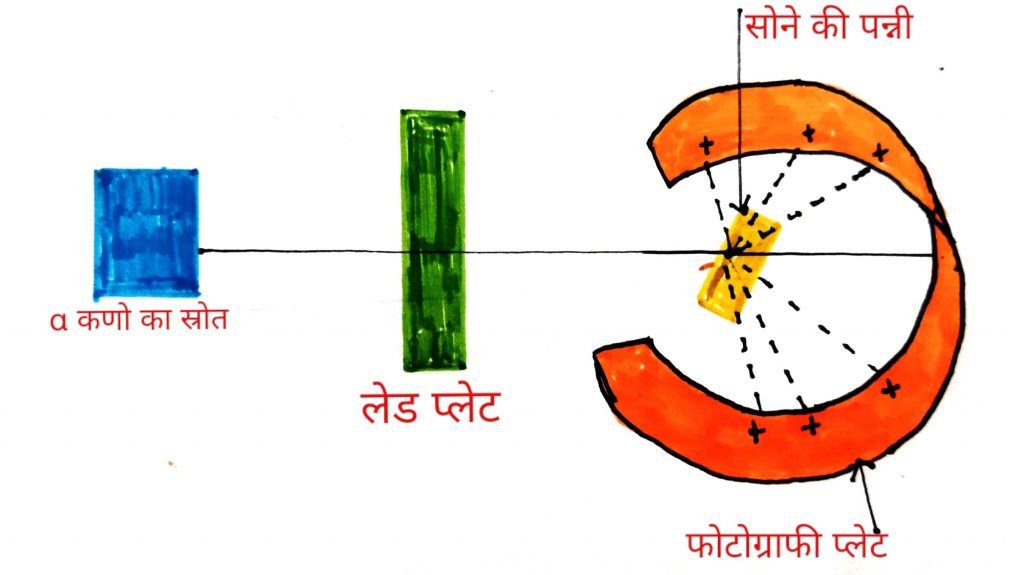
रदरफोर्ड ने एक प्रयोग किया जिसे अल्फा कण प्रकीर्णन प्रयोग भी कहा जाता है
रदरफोर्ड ने 100mm मोटाई की एक सोने की पन्नी ली जिस पर उन्होंने जिस पर एक रेडियोएक्टिव स्रोत से उच्च उर्जा वाले अल्फा कणों की बौछार करवाई जाती है जो लेड प्लेट से होकर गुजरती है इस पन्नी से कुछ दूरी की एक वृत्ताकार प्रतिदीप्तिशील पर्दा (फोटोग्राफी प्लेट) होता है जिस पर ZnS का लेप होता है जब अल्फा कण इस पर्दे पर गिरता है तो एक चमक उत्पन्न होती है
इस प्रयोग से रदरफोर्ड ने कुछ निष्कर्ष निकले जो निम्न प्रकार है
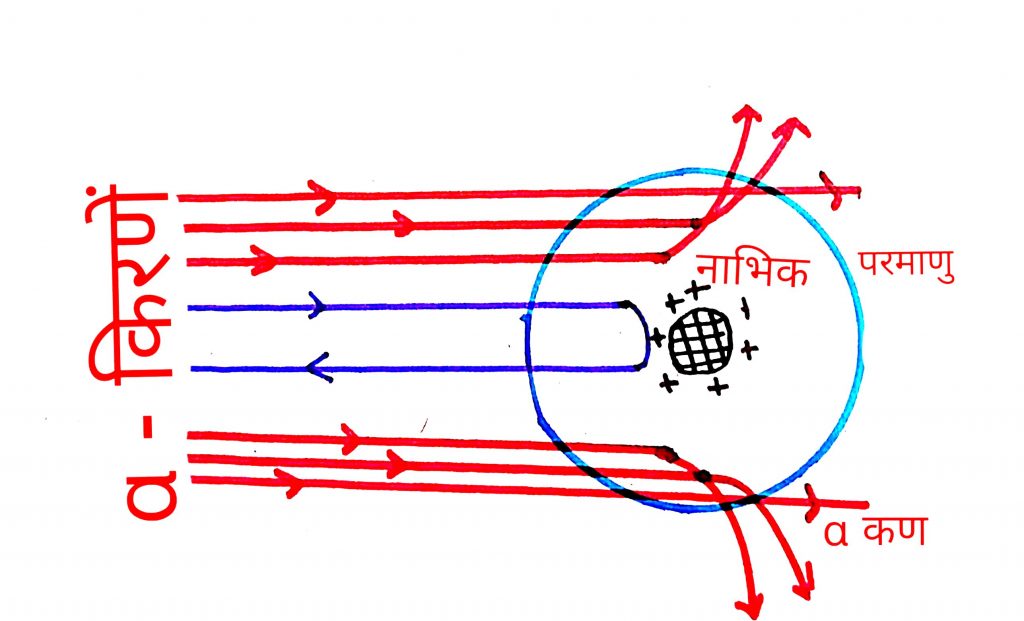
- ज्यादातर अल्फा कण बिना वीक्षेपित हुए सीधे निकल गए
- बहुत कम अल्फा कण कम कोण से ही वीक्षेपित हो जाते है
- 20000 मे से एक कण 180 कोण पर वीक्षेपित हो जाता है मतलब वह वापस लौट आता है
- परमाणु का ज्यादातर द्रव्यमान एक एक छोटे से भाग मे संचित होता है जिसे नाभिक कहा गया
- इलेक्ट्रॉन नाभिक के चारों ओर बहुत तेज गति से वृत्ताकार पथ में चक्कर लगाते हैं इसे परमाणु का सौर मंडल से भी तुलना की जाती है
- इलेक्ट्रॉन नाभिक के पास विद्युत आकर्षण बल से बंधे होते हैं
- रदरफोर्ड ने बताया की नाभिक का आयतन परमाणु के आयतन से बहुत कम होता है परमाणु की त्रिज्या 10⁻¹⁰m व नाभिक की त्रिज्या 10⁻¹⁵m होती है
रदरफोर्ड परमाणु की कुछ कमियाँ रही जो निम्न है
- रदरफोर्ड परमाणु मॉडल यह बताने में असमर्थ रहा परमाणु में इलेक्ट्रॉन किन कक्षाओं में गति करते हैं और उन कक्षा में इलेक्ट्रॉन की संख्या कितनी होनी चाहिए
- इलेक्ट्रॉन यदि लगातार वृत्ताकार कक्षाओं में गति करते हैं तो मैक्सवेल के विद्युत गति सिद्धांत के आधार पर ऊर्जा का मुक्त होनी चाहिए अर्थात इलेक्ट्रॉन की लगातार ऊर्जा में कमी होती जाएगी और इलेक्ट्रॉन की गति एवं त्रिज्या कम होती जाती है और अंत में इलेक्ट्रॉन नाभिक में गिर जाता है जिससे नाभिक नष्ट हो जाता है बल्कि ऐसा वास्तव में कुछ नहीं होता
- ऊर्जा के लगातार कमी होने से तत्वों का उत्सर्जन स्पेक्ट्रम लगातार होना चाहिए जबकि स्पेक्ट्रम रेखीय होता है
बोर का परमाणु मॉडल-
सन् 1913 मे निल्स बोर रदरफोर्ड के परमाणु मॉडल की कमियों को दूर करने एवं हाइड्रोजन परमाणु की स्पेक्ट्रम रेखाओं की व्याख्या करने के लिए प्लान के क्वांटम सिद्धांत के आधार पर परमाणु मॉडल प्रस्तुत किया जिसके प्रमुख बिंदुओं निम्नानुसार है
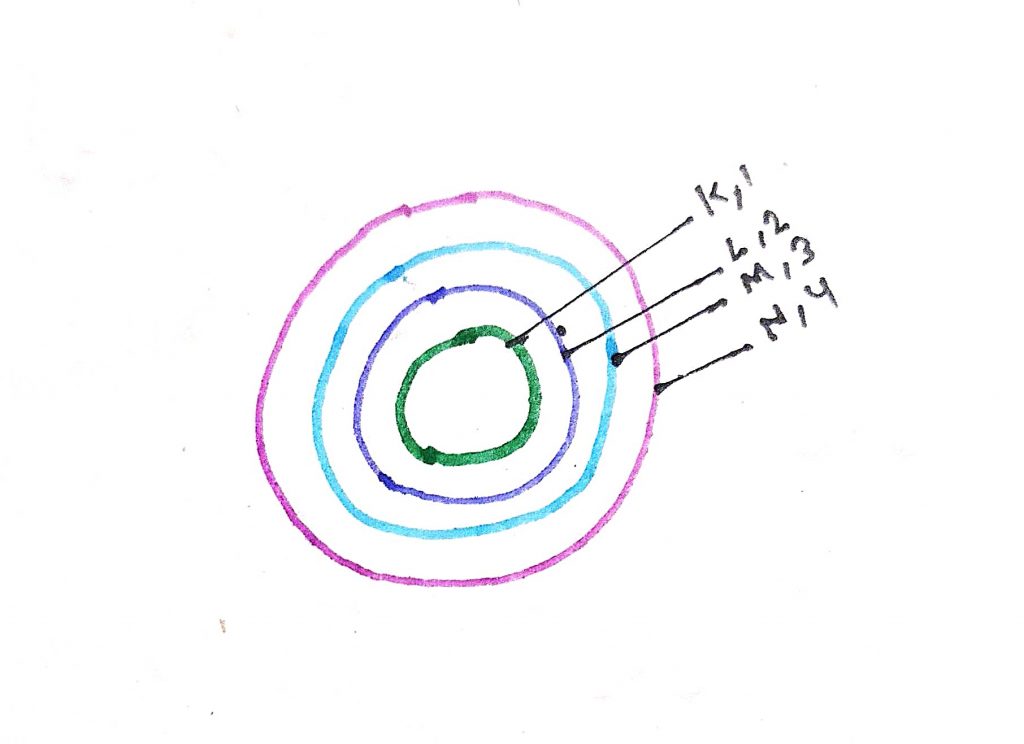
- इलेक्ट्रॉन नाभिक के चारों और कुछ नियत वृत्ताकार पथ में गति करते हैं जिन्हें कक्षा कहा जाता है
- हर कक्षा की अपनी एक नियत मात्रा में ऊर्जा होती है जिसे ऊर्जा स्तर का जाता है ऊर्जा स्रोतो को क्रमशः से 1,2,3 4 या फिर k l m n द्वारा दर्शाया जाता है
- जब इलेक्ट्रॉन वृत्ताकार कक्षा में गति करते हैं तो उनकी ऊर्जा में किसी प्रकार की कोई कमी या वृद्धि नहीं होती है
- ऊर्जा की बातें ही इलेक्ट्रॉन के कोणीय संवेग का मान भी निश्चित होता होता है MvT = nh/2π
- जब इलेक्ट्रॉन को ऊर्जा दी जाती है तो वह निम्न ऊर्जा स्तर से उच्च ऊर्जा स्तर में चला जाता है

Leave a Reply